新疆理化所从阿纳其根中发现全新骨架的非阿片类多靶点强效镇痛剂
阿纳其根是菊科芥菊(Anacyclus pyrethrum (L) Lag.)的根,为维药经典药材,常用于治疗头痛、寒性牙痛、神经衰弱等。神经性疼痛和癌痛因病理机制复杂仍是临床治疗的难点,而传统阿片类及非甾体抗炎药因成瘾性、耐药性及胃肠道出血等副作用限制其应用。目前,镇痛药物的研发主要有三大策略:一是对阿片类药物的结构进行修饰以降低呼吸抑制和成瘾风险(如dezocine、cebranopadol);二是开发新型靶点,如TRP、Kv、Cav、Nav等离子通道(如FDA批准的首个非阿片类Nav1.8抑制剂Suzetrigine);三是多靶点协同策略以增强疗效并减少耐药性(如多靶点阿片类BU08028)。尽管Suzetrigine开创了非成瘾镇痛新机制,但其单靶点高选择性可能诱发心血管风险,而多靶点阿片类药物虽可降低呼吸抑制等副作用,仍面临成瘾性问题。因此,开发非阿片类、多靶点协同镇痛且低成瘾性的镇痛药成为突破神经性疼痛和癌痛治疗瓶颈的核心路径。
近日,中国科学院新疆理化技术研究所研究人员与华中科技大学、新疆医科大学合作,从新疆民族药阿纳其根中发现了5对具有强效镇痛作用的生物碱对映体(如图1所示)。其中,Anacyphrethines A (1)和B (2)作为一类高度共轭的多甲基化6/6/6/6/5/7/5-八环四氮生物碱,具有8,14,18,24-四氮八环[16.8.2.11,23.04,28.05,17.09,16.011,15.021,27]二十九烷核心的新骨架。综合利用核磁共振数据分析、量子化学计算以及单晶X-射线衍射等多种技术确定了它们的化学结构及绝对构型,并推测了它们独特的含氮聚酮生物合成途径,包括关键的醛醇缩合、氢胺化和希夫碱反应。5对对映体在醋酸诱导的小鼠扭体实验中均表现出显著的镇痛活性。其中,化合物1的消旋体((±)-1)、化合物1的右旋异构体((+)-1)、化合物3的消旋体((±)-3)以及化合物5的左旋异构体((−)-5)在0.2 mg/kg的较低剂量下表现出比吗啡更强的镇痛活性。值得注意的是,消旋体(±)-1在5和1 mg/kg剂量下镇痛活性强于其右旋和左旋异构体(+)-1和(−)-1。且在五个测试剂量下,化合物1的右旋异构体((+)-1)比左旋异构体((−)-1)具有更强的镇痛活性。
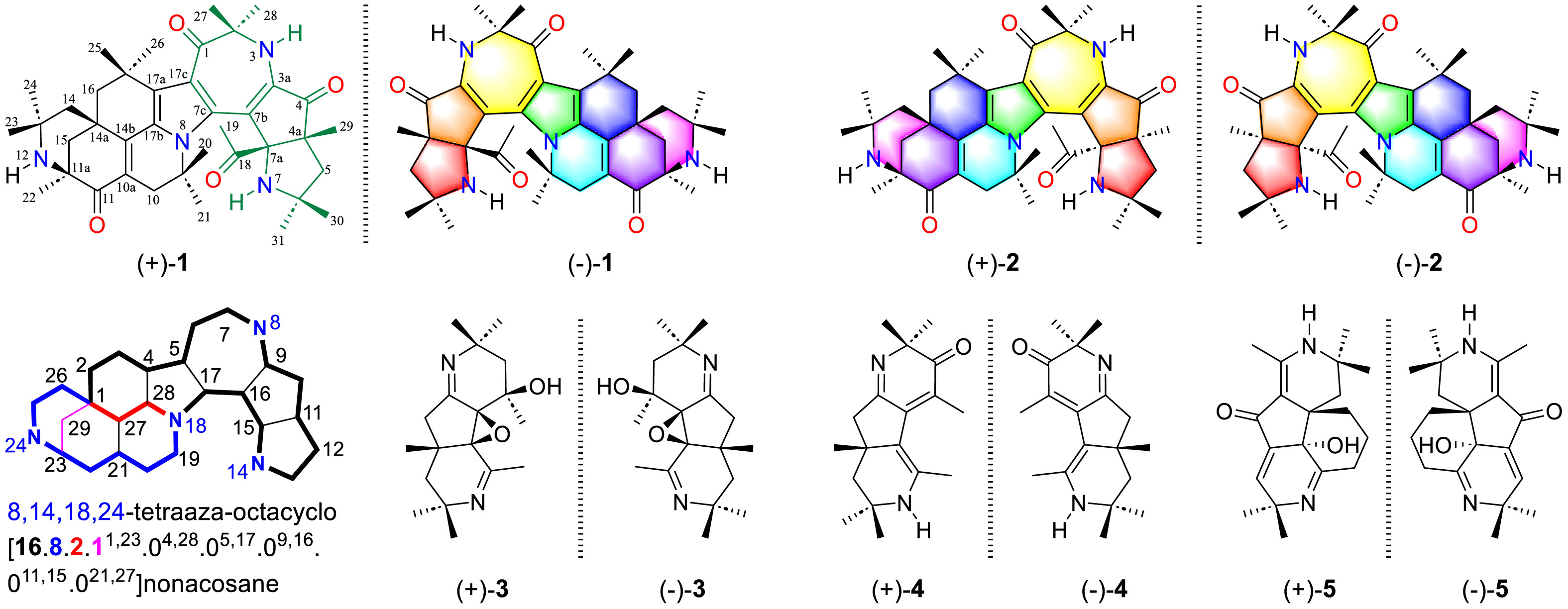
图1. 化合物1−5的化学结构和全新骨架的环系命名
为阐明(+)-1和(−)-1的镇痛机制,研究人员测试了二者对44个与镇痛相关的离子通道和受体的作用。结果显示,(+)-1和(−)-1均不激动阿片受体,是非阿片类强效镇痛剂。进一步研究发现,(+)-1对TRPM8、Kv1.2、Kv1.3、Cav2.1等多个离子通道均有显著抑制作用,IC50值分别为1.10 ± 0.26、4.20 ± 0.07、2.20 ± 0.24、10.40 ± 0.69 μmol/L;而(−)-1则选择性抑制TRPC6、Kv1.2和Kv1.3等多个离子通道,IC50值分别为0.81 ± 0.05、0.91 ± 0.04、1.50 ± 0.13 μmol/L。因此,(+)-1和(−)-1在结构和机制上完全不同于已有的阿片类多靶点镇痛药,如dezocine25、cebranopadol26和BU0802827。作为一种全新化学骨架的非阿片类多靶点镇痛剂,(±)-1在治疗神经性、创伤性和炎症性疼痛综合征方面潜力巨大。分子对接分析和动力学模拟为开发非阿片类强效镇痛药奠定了结构基础。
相关成果以“Anacyphrethines A and B as potent analgesics: Multiple ion channel inhibitors with an unprecedented chemical architecture”为题发表在中国科学院一区杂志《药学学报》(Acta Pharmaceutica Sinica B)上。中国科学院新疆理化技术研究所为第一完成单位,中国科学院新疆理化技术研究所/新疆医科大学的阿吉艾克拜尔×艾萨研究员和华中科技大学的姚广民教授为通讯作者,中国科学院新疆理化技术研究所助理研究员陈慧为第一作者。该工作得到了国家重点研发计划、中国科学院生物资源计划、国家自然科学基金、华中科技大学交叉研究计划和湖北省重点研发计划国际合作等项目的资助。
(原文链接)
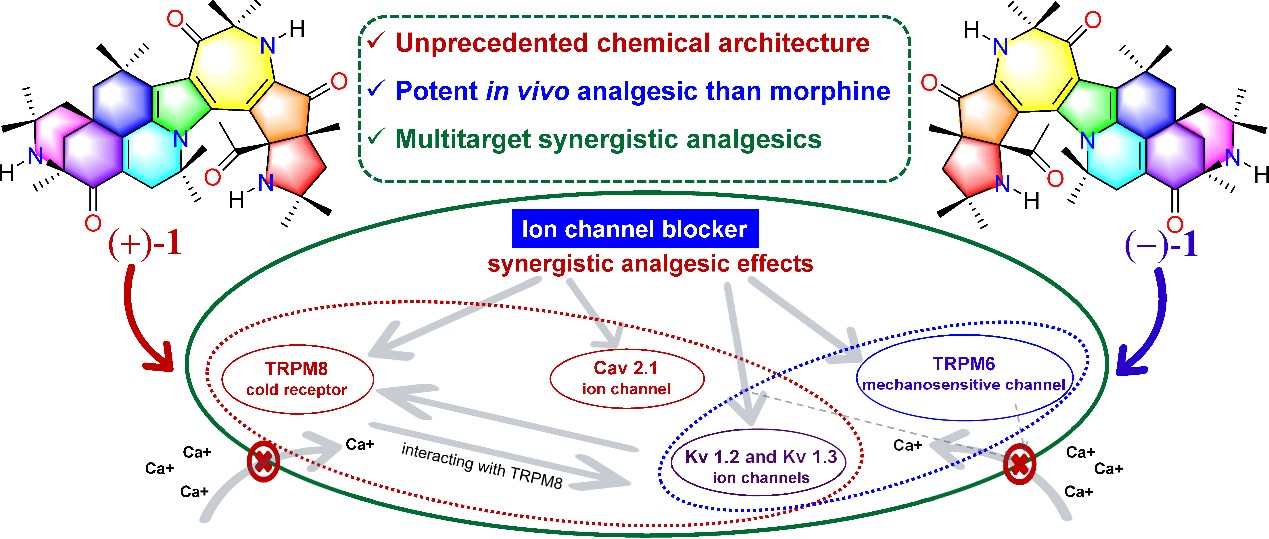
图2. (+)-1和(−)-1通过抑制多种非阿片类离子通道产生强效镇痛作用